Im Labor: ein konkreter Schritt hin zum universellen Organ
Diese Woche veröffentlichten Forscher Ergebnisse, die einen präzisen biochemischen Kniff beschreiben, der uns dem lang ersehnten Versprechen näher bringt, das in der Schlagzeile mitschwingt: Durchbruch: Wissenschaftler erschufen „universelle“ Organe. Teams unter der Leitung der University of British Columbia und Kooperationspartner nutzten im Labor gezüchtete Enzyme, um die Zuckermarker zu entfernen, die die Blutgruppe A bei einer Spenderniere definieren. Dadurch wandelten sie diese in ein enzymatisch umgewandeltes Organ der Blutgruppe 0 um und implantierten es mit Zustimmung der Angehörigen einem hirntoten Empfänger. Das Organ funktionierte mehrere Tage lang mit nur begrenzten immunologischen Problemen, was Klinikern und Wissenschaftlern das erste menschliche Modell eines Organs lieferte, das weitgehend mit jeder Blutgruppe kompatibel gemacht wurde.
Der Befund wurde 2025 in Nature Biomedical Engineering veröffentlicht und ist das Ergebnis von mehr als einem Jahrzehnt schrittweiser Arbeit an Enzymen, die spezifische Kohlenhydratstrukturen von Zelloberflächen abschneiden können. Für Patienten, die auf Transplantationen warten – von denen viele jahrelang warten müssen, weil ihre Blutgruppe die Zahl kompatibler Spender einschränkt – ist die Vorstellung einer Niere, die zu jeder Blutgruppe passt, mehr als eine Laborkuriosität: Es ist ein potenzieller Weg, um Wartelisten und die Todesfälle darauf drastisch zu reduzieren.
Durchbruch: Wissenschaftler erschufen „universelle“ Niere — wie der Enzym-Trick funktioniert
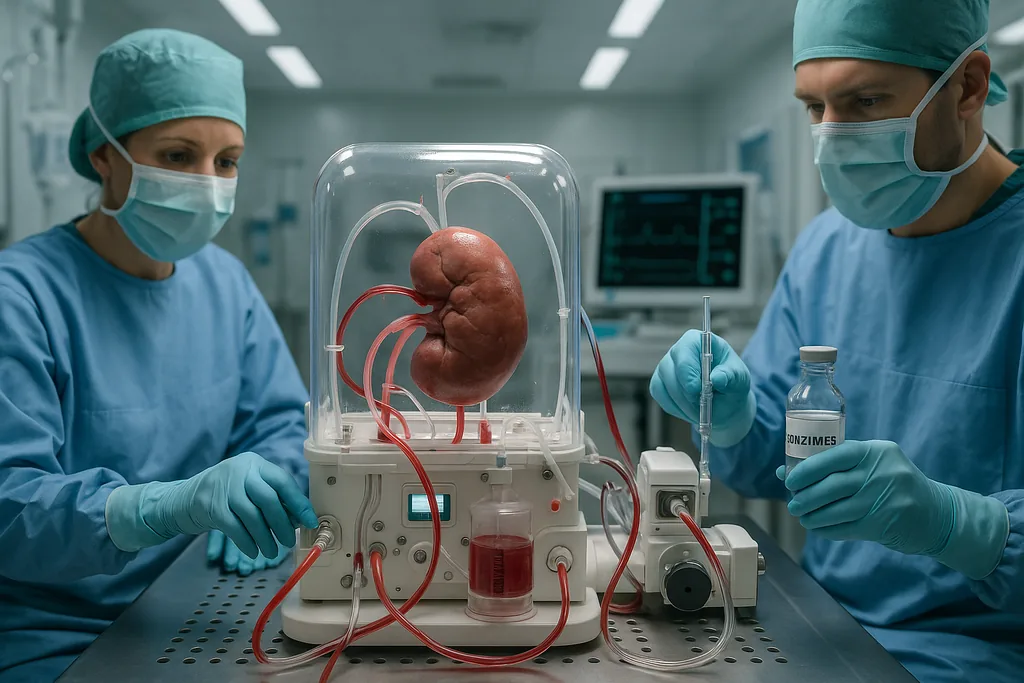
Die Forscher passten Enzyme an, die in früheren Studien entdeckt und optimiert wurden und wie eine molekulare Schere wirken: Sie entfernen gezielt die endständigen Zucker, welche die Antigene der Blutgruppe A oder B sichtbar machen. Werden diese Zucker entfernt, verhält sich die Oberfläche der Blutgefäße des Organs für eine gewisse Zeit wie Blutgruppe 0 – was funktionell der universelle Typ ist, da das Immunsystem der meisten Menschen keine Anti-0-Reaktionen zeigt.
Praktisch gesehen perfundierte das Team eine Spenderniere ex vivo mit einem Cocktail, der diese Enzyme enthielt, wodurch ein enzymatisch umgewandeltes Organ (oft als ECO abgekürzt) entstand. Labor- und präklinische Tests hatten gezeigt, dass der Ansatz bei Blut (wo die Enzyme zuerst getestet wurden) und bei isolierten Organen funktionieren könnte. Die neue Arbeit weitete dies auf ein in einen menschlichen Körper transplantiertes Organ aus – wenn auch einen ohne Hirnfunktion –, um die Kompatibilität und frühe Immunreaktionen zu beobachten.
Durchbruch: Wissenschaftler erschufen „universelle“ Niere — der erste Test am Menschen und was geschah
Die umgewandelte Niere wurde einem hirntoten Empfänger mit voller Zustimmung der Angehörigen transplantiert, damit die Forscher überwachen konnten, wie sich das Organ in einem lebenden Kreislauf verhält. Etwa zwei Tage lang funktionierte die Niere ohne hyperakute Abstoßung – jene katastrophale Immunreaktion, die ein unverträgliches Transplantat innerhalb von Minuten zerstören kann. Das allein stellt einen bedeutenden Meilenstein dar: Ein umgewandeltes Organ überlebte den ersten Kontakt mit einem vollständig intakten menschlichen Immunsystem.
Das Laborergebnis in nutzbare Transplantate übersetzen
Was ist also eine universelle Niere und wie funktioniert sie in der klinischen Alltagssprache? In diesem Zusammenhang ist eine „universelle Niere“ ein Spenderorgan, dessen Oberflächenantigene chemisch oder enzymatisch so modifiziert wurden, dass das Organ keine Blutgruppenmarker mehr trägt, die eine sofortige antikörpervermittelte Abstoßung auslösen würden. Es funktioniert, indem das sichtbare zelluläre „Namensschild“ des Spenders durch eine neutrale Oberfläche ersetzt wird, was effektiv den Pool an Empfängern erweitert, die dieses Organ ohne langwierige Abstimmung oder gefährliche Vorkonditionierung annehmen könnten.
Risiken, Ethik und der Weg zu klinischen Studien
Sind universelle Organe heute bereits für Transplantationen verfügbar? Nein. Die Transplantation am Menschen war ein kontrollierter Forschungsschritt, kein klinisches Angebot. Vor jeder routinemäßigen klinischen Anwendung muss die Technik behördliche Prüfungen, Sicherheitstests und größere klinische Studien durchlaufen. Das aus der Forschung hervorgegangene Unternehmen – Avivo Biomedical – bereitet sich darauf vor, Genehmigungen einzuholen und Studien durchzuführen, aber diese Prozesse dauern in der Regel Jahre. Forscher betonen, dass dies eine Brücke zwischen starken Laborbelegen und der schließlichen Patientenversorgung ist, nicht der Endpunkt.
Die kurzfristigen Risiken bestehen in Immunreaktionen, sobald die Antigene wieder auftauchen, unvorhergesehenen Nebenwirkungen der Enzymbehandlung auf Gefäßzellen und potenziellen Einflüssen auf die langfristige Gesundheit des Transplantats. Es gibt auch ethische Erwägungen: Der erste Test am Menschen stützte sich auf einen hirntoten Spender mit Zustimmung der Angehörigen – ein notwendiges, aber sensibles Studiendesign, das die Möglichkeit bot, das Organ in einem lebenden Kreislauf zu überwachen, ohne einen aktiven Patienten einem unmittelbaren Risiko auszusetzen.
Längerfristig müssen die Teams nachweisen, dass die Umwandlung dauerhaft genug ist, um die Ergebnisse maßgeblich zu verbessern, und dass jede Lockerung der Matching-Beschränkungen keine neuen Schwachstellen schafft – wie etwa verborgene antigene Veränderungen oder eine erhöhte Infektionsanfälligkeit. Die Aufsichtsbehörden werden sorgfältig gestaffelte Humanstudien verlangen, die kurz- und langfristige Abstoßungsraten, Funktion und Sicherheit bei verschiedenen Empfängern messen.
Auswirkungen auf das System und wann könnte dies Patienten helfen?
Sollte der Ansatz die Studien bestehen, könnte er die Organzuteilung verändern und Ungerechtigkeiten verringern. Empfänger mit Blutgruppe 0 dominieren derzeit viele Nierenwartelisten und warten länger, da echte Spenderorgane der Blutgruppe 0 knapp sind; die Umwandlung von A- oder B-Nieren in funktionelle 0-Organe könnte die verfügbaren Organe erhöhen und die Wartezeiten verkürzen. Realistische Zeitpläne gehen jedoch davon aus, dass eine breite klinische Verfügbarkeit eher Jahre als Monate entfernt ist. Forscher und Unternehmenspartner beschreiben einen Pfad, der, wenn alles gut geht, in wenigen Jahren zu schrittweisen klinischen Studien führt, gefolgt von größeren Wirksamkeitsstudien und der behördlichen Prüfung.
Die Risiko-Nutzen-Abwägung für einen einzelnen Patienten wird von seinem medizinischen Zustand und den verfügbaren Alternativoptionen abhängen. Für viele würde ein früherer Zugang zu einem funktionierenden Transplantat – sofern es sich als sicher erweist – einige Unsicherheiten bei weitem aufwiegen. Für Kliniker und Transplantationsdienste könnte die Technik die straffe Choreografie lockern, die derzeit für die Paarung von Spendern und Empfängern erforderlich ist, und gleichzeitig den Druck auf Lebendspendeprogramme lindern.
Was noch gelöst werden muss
- Haltbarkeit: Verhindern des Wiederauftretens von Antigenen oder deren Kontrolle über klinisch relevante Zeiträume hinweg.
- Immunologie: Bewertung, wie Nicht-ABO-Immunmechanismen mit umgewandelten Transplantaten interagieren.
- Herstellung und Logistik: Skalierung der Enzymproduktion und Erstellung von Protokollen für eine sichere, schnelle Organumwandlung vor der Transplantation.
- Ethik und Zugang: Gewährleistung eines gerechten Einsatzes, damit die Vorteile diejenigen erreichen, die sie am dringendsten benötigen.
Die Schlagzeile hält einen vielversprechenden Meilenstein fest: Durchbruch: Wissenschaftler erschufen „universelle“ Organe ist noch keine Übertreibung, sondern eine prägnante Beschreibung einer starken Idee, die nun zum ersten Mal in der menschlichen Physiologie demonstriert wurde. Die Umwandlungstechnik beantwortet eine klare wissenschaftliche Frage – wie man eine Niere für jede Blutgruppe passend macht – und eröffnet gleichzeitig ein längeres, praktisches Gespräch über Sicherheit, Regulierung und gerechte Einführung. Wenn nachfolgende Studien den dauerhaften Nutzen bestätigen, könnte die Veränderung für die Menschen, die jedes Jahr beim Warten auf eine Niere sterben, tiefgreifend sein.
Quellen
- Nature Biomedical Engineering (Forschungsarbeit über enzymatisch umgewandelte Organe)
- University of British Columbia (Forschungsteams und Pressematerialien)
- Avivo Biomedical (Unternehmen, das die klinische Umsetzung entwickelt)
- Centre for Blood Research, University of British Columbia
Kommentare
Noch keine Kommentare. Seien Sie der Erste!