Onderzoekers vinden een verrassende moleculaire redding voor bepaalde vormen van doofheid
In een artikel dat dit jaar is gepubliceerd in een vooraanstaand klinisch tijdschrift, heeft een internationaal team onder leiding van de University of Chicago een genetische oorzaak van congenitaal sensorineuraal gehoorverlies geïdentificeerd en — belangrijker nog — manieren aangetoond om de schade in laboratoriummodellen te herstellen. De schuldige is een voorheen ondergewaardeerde rol van het CPD-gen, en de remedie die ze hebben getest omvat L-arginine-supplementen en sildenafil, het actieve ingrediënt in medicijnen die vooral bekend zijn voor de behandeling van erectiestoornissen.
Wat het team ontdekte
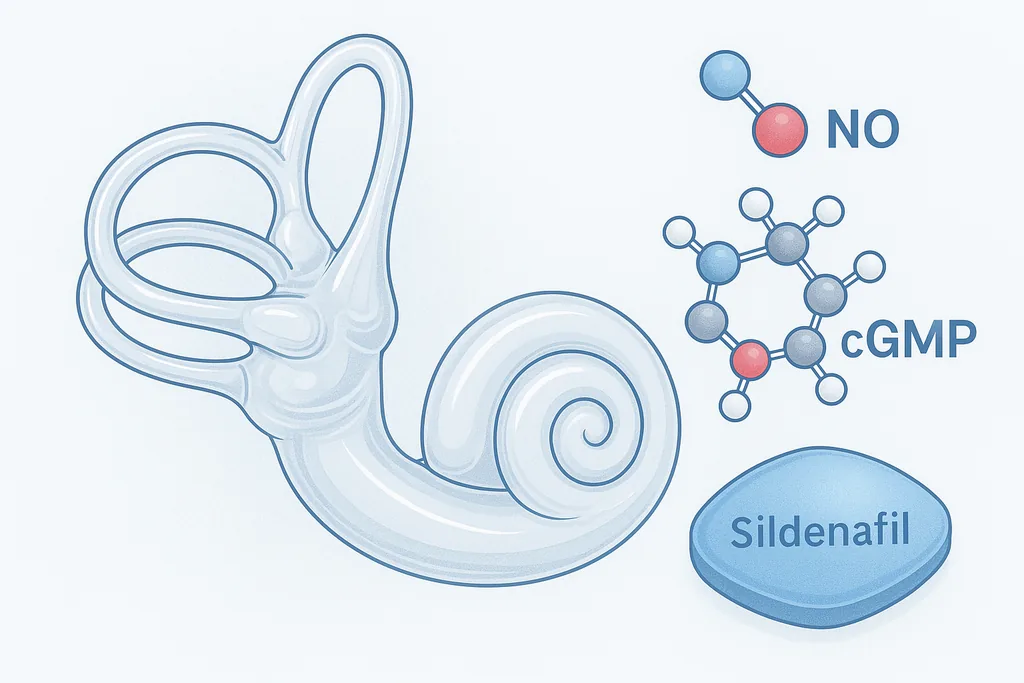
Op cellulair niveau blijkt CPD-activiteit belangrijk te zijn voor het behoud van arginine — het aminozuursubstraat dat nodig is voor de aanmaak van stikstofoxide (NO). In de delicate sensorische haarcellen van het binnenoor vermindert het verlies van CPD de beschikbaarheid van arginine en de stroomafwaartse NO-signalering. Dat tekort verhoogt de cellulaire stress en activeert routes die leiden tot haarceldood, de onherstelbare schade die ten grondslag ligt aan vele vormen van sensorineuraal gehoorverlies.
Hoe sildenafil in de biologie past
Stikstofoxide fungeert als een signaalmolecuul dat, naast andere effecten, de productie van cyclisch GMP (cGMP) stimuleert. Enzymen die bekendstaan als fosfodiësterasen (PDE's) breken cGMP af; sildenafil remt een van die enzymen (PDE5), waardoor de cGMP-signalering effectief wordt versterkt. In de studie redeneerde het team dat het versterken van cGMP de verminderde NO-productie als gevolg van CPD-deficiëntie zou kunnen compenseren.
In gekweekte, van patiënten afgeleide cellen, in organotypische cochleaire preparaten van muizen en in fruitvliegmodellen van CPD-verlies, verbeterde het supplementeren van arginine of het farmacologisch versterken van de cGMP-route met sildenafil de overleving van cellen en herstelde het gedeeltelijk de auditieve functie. Bij vliegen verbeterden gedragsmetingen gerelateerd aan gehoor en evenwicht. In cochleaire culturen en celsystemen namen markers voor oxidatieve stress en endoplasmatisch-reticulumstress af wanneer arginine of sildenafil werd toegediend.
Waarom dit opmerkelijk is
- Een gedefinieerd moleculair mechanisme: het werk koppelt een enkele biochemische route — arginine → stikstofoxide → cGMP — aan de gezondheid van haarcellen, wat een duidelijk doelwit biedt voor interventie.
- Therapeutisch potentieel voor een genetische vorm van doofheid: in tegenstelling tot het meeste sensorineurale gehoorverlies, waarbij geen medicamenteuze behandelingen de schade ongedaan maken, lijkt deze vorm in modellen vatbaar voor biochemische redding.
- Herbestemming van een bekend medicijn: omdat sildenafil al door de FDA is goedgekeurd voor andere toepassingen, zou de weg van het lab naar klinische tests sneller kunnen verlopen dan voor een volledig nieuwe verbinding — hoewel die snelheid gepaard gaat met kanttekeningen die hieronder worden beschreven.
Belangrijke kanttekeningen en onbeantwoorde vragen
Ondanks de belofte manen verschillende redenen tot voorzichtigheid voordat sildenafil als een geneesmiddel voor doofheid wordt beschouwd.
- Zeldzame, specifieke mutaties: de experimenten richten zich op 'loss-of-function'-varianten van CPD. Het meeste gehoorverlies in de populatie is leeftijdsgebonden of door lawaai veroorzaakt en heeft complexe oorzaken; het is nog niet bekend hoe vaak CPD-varianten bijdragen aan menselijke doofheid buiten de beschreven families.
- Modelsystemen zijn geen mensen: het team gebruikte muizen, gekweekte menselijke cellen en fruitvliegen. Dit zijn krachtige instrumenten om mechanismen en proof-of-concept vast te stellen, maar ze kunnen de veiligheid, dosering, distributie in het menselijke binnenoor of langetermijneffecten niet volledig voorspellen.
- Systemische versus lokale dosering: sildenafil circuleert door het hele lichaam. Of effectieve doses voor het binnenoor systemisch veilig zouden zijn — of dat lokale toediening aan het slakkenhuis vereist zou zijn — is nog onduidelijk. Het binnenoor is een klein, hermetisch afgesloten orgaan waar de toegang en concentratie van medicijnen sterk verschillen van andere weefsels.
- Gemengd bewijs uit het verleden: onderzoek bij dieren in de afgelopen tien jaar heeft gemengde signalen opgeleverd over de vraag of PDE5-remmers het gehoor onder verschillende omstandigheden beschermen of juist schaden. Sommige studies rapporteren beschermende effecten in modellen voor lawaai of explosies; andere laten geen verandering zien. Bij mensen zijn er zeldzame gevallen gemeld die wijzen op plotselinge gehoorveranderingen bij gebruik van PDE5-remmers, maar het bewijs op populatieniveau is inconsistent. Grondige klinische evaluatie zal noodzakelijk zijn.
Wat is de volgende stap?
Het typische traject van een studie als deze naar klinisch gebruik omvat verschillende stappen. Onderzoekers moeten eerst bevestigen hoe vaak CPD-varianten voorkomen in bredere cohorten met gehoorverlies en bepalen of een gedeeltelijke CPD-functie of varianten met een enkele kop de gevoeligheid voor gehoorverslechtering op latere leeftijd verhogen. Daarna volgen preklinische studies om de dosering, toedieningsmethode en timing te optimaliseren, gevolgd door zorgvuldig opgezette vroege menselijke trials die zich richten op veiligheid en biologische activiteit in het oor, in plaats van onmiddellijk gehoorherstel.
Als vroege menselijke studies een veilig doseringsvenster vinden en bewijs dat het medicijn de cochleaire doelwitten bereikt, zouden kleine effectiviteitstesten kunnen uitwijzen of arginine-supplementen, systemische sildenafil of gerichte cochleaire toediening het gehoor verbetert of de achteruitgang vertraagt bij mensen met bevestigde CPD-gerelateerde defecten. Omdat sildenafil al is goedgekeurd voor andere indicaties, zullen regelgevende instanties nog steeds specifieke veiligheids- en werkzaamheidsgegevens eisen voor elk nieuw gebruik.
Het grotere geheel
Naast het specifieke CPD-verhaal illustreert dit werk twee bredere trends in modern biomedisch onderzoek. Ten eerste kan genetisch speurwerk — het koppelen van zeldzame familiale gevallen aan moleculaire routes — beïnvloedbare kwetsbaarheden aan het licht brengen die in populatiestudies over het hoofd worden gezien. Ten tweede is de herbestemming van bestaande medicijnen op basis van moleculair inzicht een efficiënte translationele strategie wanneer de biologie duidelijk is en het veiligheidsprofiel van het medicijn goed is gekarakteriseerd.
Ik ben James Lawson, verslaggever voor Dark Matter. Dit onderzoek herinnert ons eraan dat gevestigde medicijnen soms verrassende nieuwe toepassingen kunnen vinden wanneer ze worden bekeken door de lens van moderne genetica en moleculaire neurowetenschappen.
Comments
No comments yet. Be the first!