Lead: strzykawka, DNA i znikająca broń
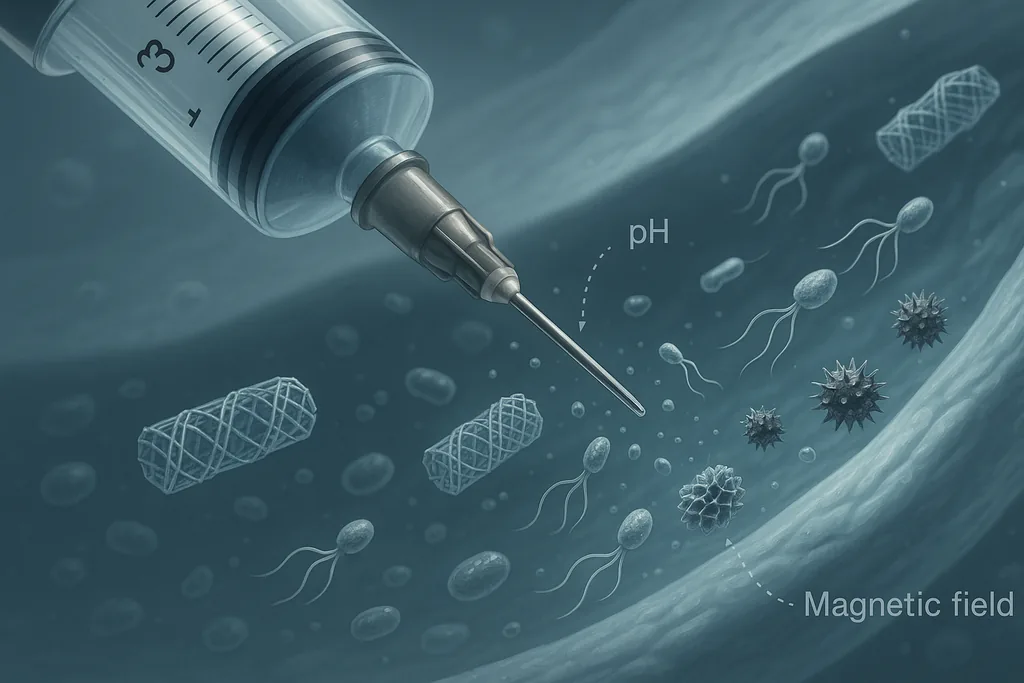
W laboratorium w Karolinska Institutet naukowcy złożyli nici DNA w pustą w środku rurkę nie szerszą niż wirus, umieścili w jej wnętrzu peptydową „broń” i wstrzyknęli taką konstrukcję myszom z guzami piersi. Peptyd pozostawał ukryty, gdy nanostruktura krążyła we krwi, ale rozwinął się i odsłonił swój zabójczy wzór w kwaśnym mikrośrodowisku otaczającym guzy – powodując około 70-procentową redukcję wzrostu nowotworu u zwierząt w porównaniu z nieaktywną grupą kontrolną. Praca ta, opisana w czasopiśmie Nature Nanotechnology i przedstawiona w tegorocznym komunikacie prasowym uniwersytetu, jest jedną z kilku uderzających demonstracji tego, że architektury często określane mianem „nanorobotów” mogą wykonywać celowe działania wewnątrz żywych organizmów.
Różne oblicza wstrzykiwalnych nanomaszyn
Inne zespoły rozwijają biohybrydowe mikroroboty, które potrafią pływać. Naukowcy z University of California San Diego przymocowali nanocząsteczki wypełnione lekami do ruchliwych alg, tworząc maleńkich pływaków, którzy mogą przenosić ładunek głęboko do tkanki płucnej i docierać do guzków przerzutowych; u myszy pływacy spowolnili rozprzestrzenianie się nowotworu i poprawili przeżywalność w porównaniu z grupami kontrolnymi. Systemy te są większe (skala mikrometryczna, a nie nanometryczna) i wykorzystują naturalny napęd, a nie czyste składanie molekularne.
Gdzie nazwa „robot” pomaga – a gdzie wprowadza w błąd
Nazywanie tych urządzeń „robotami” ma silny wydźwięk retoryczny, ale może przesłaniać rzeczywistość techniczną. W przeciwieństwie do robotów makroskopowych, większość projektów przeznaczonych do wstrzykiwania nie posiada pokładowych procesorów, silników ani baterii. Ich inteligencja zazwyczaj wynika z chemii: sekwencji DNA lub białek, które zmieniają konformację w odpowiedzi na sygnał molekularny, lub z fizycznego sterowania za pomocą magnesów. Zachowania te są programowalne i powtarzalne, ale nie stanowią autonomicznego poznania; przypominają raczej warunkowe magazyny leków niż miniaturowe androidy. Mimo to termin ten oddaje fakt, że konstrukty te potrafią wyczuwać, zmieniać kształt i wywoływać efekt terapeutyczny in situ – zestaw możliwości, które jeszcze niedawno należały do sfery science fiction.
Dlaczego wyniki na zwierzętach są obiecujące, ale nie rozstrzygające
Badania na myszach są niezbędnymi pierwszymi krokami, ale pozostawiają kilka kluczowych pytań bez odpowiedzi. Modele nowotworowe u myszy często mają prostszą strukturę naczyń krwionośnych i kontekst immunologiczny niż nowotwory u ludzi; biodystrybucja, akumulacja poza celem i ogólnoustrojowe odpowiedzi immunologiczne mogą się radykalnie różnić przy przejściu do większych zwierząt i ludzi. W przypadku urządzeń opartych na DNA przeszkodami praktycznymi są degradacja przez nukleazy we krwi, niezamierzone rozpoznanie immunologiczne oraz bezpieczna, spójna produkcja na dużą skalę. W przypadku biohybryd i systemów magnetycznych nierozwiązane pozostają kwestie długoterminowej biokompatybilności, ryzyka zatorów oraz zdolności do dostarczenia wystarczającej ilości aktywnego ładunku do klinicznie istotnej części tkanki nowotworowej. Naukowcy dostrzegają te luki: zespoły stojące za nanostrukturą DNA aktywowaną przez pH oraz nanorobotem trombinowym wezwały do przeprowadzenia testów na bardziej zaawansowanych modelach chorób i gruntownych badań bezpieczeństwa przed rozpoczęciem prób na ludziach.
Przeszkody produkcyjne, stabilność i regulacje
Przeniesienie systemów w skali nano do medycyny wymaga powtarzalnej produkcji o wysokiej wydajności oraz rygorystycznej kontroli jakości. Origami DNA zależy obecnie od długich nici rusztowania i wielu krótkich oligonukleotydów spinających; nawet przy postępach pozwalających na oszczędne trasowanie rusztowania i ponowne wykorzystanie sekwencji spinających, koszty i kontrola procesu pozostają niebagatelne. Niedawne prace inżynieryjne zmniejszyły złożoność i poprawiły zasady montażu, ale produkcja do użytku klinicznego będzie wymagała nowych standardów czystości, kontroli endotoksyn i spójności partii. Organy regulacyjne będą również wymagać jasnych mechanizmów działania i marginesów bezpieczeństwa: na przykład urządzenie, które celowo wywołuje miejscowe krzepnięcie, musi w przekonujący sposób unikać koagulacji ogólnoustrojowej. Dziedzina ta wciąż buduje zestawy narzędzi technicznych i regulacyjnych, aby takie demonstracje stały się rutyną.
Ścieżki do kliniki i prawdopodobny harmonogram
Nie wszystkie podejścia napotykają tę samą drogę do zastosowania klinicznego. Prostsze systemy dostarczania ładunku, które wykorzystują znane substancje biologiczne, mogą szybciej przejść przez bramki regulacyjne niż całkowicie nowatorskie maszyny molekularne. Urządzenia wykorzystujące kontrolę zewnętrzną (magnetyczną, ultradźwiękową) mogą bazować na uznanych platformach obrazowania i interwencyjnych, co potencjalnie skróci czas rozwoju klinicznego, jeśli uda się wykazać bezpieczeństwo. Wielu badaczy przewiduje etapowe wdrażanie: najpierw zastosowania miejscowe lub ex vivo (takie jak celowana zakrzepica podczas zabiegów chirurgicznych), następnie ściśle kontrolowane próby pod kontrolą obrazowania u pacjentów z ograniczonymi opcjami terapeutycznymi, a na końcu szersze wskazania, jeśli bezpieczeństwo i skuteczność zostaną potwierdzone.
Realistyczne szacunki naukowców zaangażowanych w te prace sugerują, że miną lata, a nie miesiące, zanim dojdzie do pierwszych badań większości koncepcji na ludziach; nawet optymistyczne scenariusze wymagają wieloletniej toksykologii, produkcji na dużą skalę i współpracy z organami regulacyjnymi. Jednak tempo postępu – kilka odrębnych demonstracji in-vivo w różnych instytucjach w ciągu zaledwie kilku lat – sprawia, że idea użytecznych klinicznie nanomaszyn wstrzykiwalnych staje się realną perspektywą średnioterminową, a nie tylko mrzonką.
Implikacje etyczne, kliniczne i systemowe
Poza skutecznością i bezpieczeństwem pojawiają się pytania społeczne. Kto zapłaci za złożone, potencjalnie drogie nanoleki? Jak zapewnić do nich sprawiedliwy dostęp? Jakie ramy odpowiedzialności cywilnej mają zastosowanie, jeśli urządzenie sterowane zewnętrznie spowoduje niezamierzone szkody? Wczesne zaangażowanie technologów, klinicystów, regulatorów i etyków będzie niezbędne do ukształtowania badań i wdrażania technologii w sposób rygorystyczny naukowo i odpowiedzialny społecznie.
Podsumowanie: nie jutrzejsze lekarstwo, ale wiarygodny zestaw narzędzi
Ostatnia fala publikacji i komunikatów prasowych – od aktywowanego pH origami DNA ukrywającego cytotoksyczne peptydy po urządzenia uwalniające trombinę i biohybrydowych pływaków dostarczających leki do przerzutów w płucach – wskazuje na zbieżny trend: inżynierowie i biolodzy konstruują programowalne, wstrzykiwalne struktury, które potrafią wyczuwać, lokalizować i działać wewnątrz żywej tkanki. Możliwości te stanowią realny postęp technologiczny. Jednocześnie droga od myszy do leku jest długa, a każdy projekt niesie ze sobą własne zagadki techniczne i regulacyjne. W nadchodzących latach należy spodziewać się ostrożnych, etapowych testów klinicznych najpierw najbezpieczniejszych i najprostszych projektów, podczas gdy bardziej ambitne, wielofunkcyjne nanoroboty będą nadal dojrzewać w laboratoriach przedklinicznych.
Źródła
- Nature Nanotechnology (artykuł o nanostrukturach DNA aktywowanych przez pH)
- Karolinska Institutet (komunikat prasowy i materiały badawcze)
- Nature Biotechnology (nanorobot DNA dostarczający trombinę)
- Science Advances / University of California San Diego (mikroroboty do przerzutowych nowotworów płuc)
- Advanced Science / University of Illinois Urbana‑Champaign (obrazowanie i celowanie origami DNA w raku trzustki)
Comments
No comments yet. Be the first!