“Sono a rischio costante di tumori” — vivere con una rara variante di Cowden
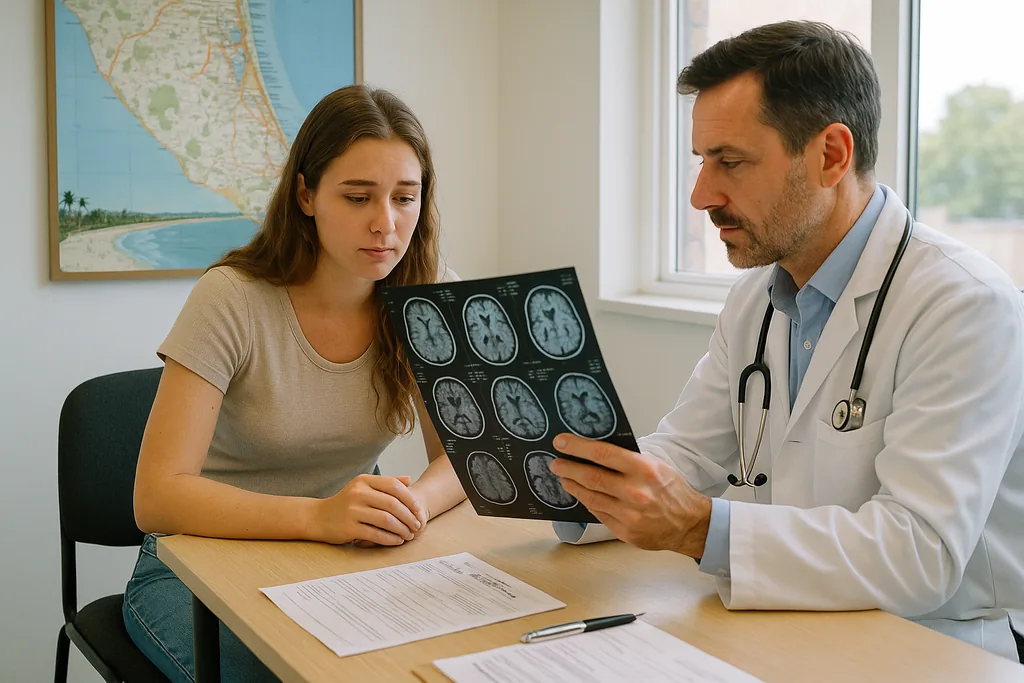
“Sono costantemente a rischio di tumori... avrò bisogno di esami per il resto della mia vita”, afferma Bella Grambau, una donna della Gold Coast la cui diagnosi di una rara variante della sindrome di Cowden l'ha inserita in un programma di sorveglianza permanente. La descrizione di Bella — che deve sottoporsi a “praticamente ogni test, ogni sei mesi, per tutta la vita” — cattura la cruda realtà per le persone affette da sindromi tumorali ereditarie ad alta penetranza: l’alterazione genetica non garantisce l’insorgenza di un cancro, ma ne aumenta le probabilità al punto che le équipe mediche raccomandano uno screening proattivo e continuo.
Sono a rischio costante di tumori — come si presenta un programma di sorveglianza
La sorveglianza per le sindromi genetiche ad alto rischio è strutturata e spesso intensiva. È personalizzata in base al gene specifico coinvolto, all'età, al sesso e alla storia clinica personale del paziente, ma alcuni elementi ricorrono in tutti i programmi: diagnostica per immagini programmata, esami clinici specialistici e procedure temporizzate per individuare precocemente tumori trattabili. Per le persone affette dalla sindrome di Cowden, le linee guida utilizzate dai genetisti clinici e dagli oncologi includono generalmente imaging mammario regolare (spesso risonanza magnetica e mammografia annuali a partire da un'età inferiore alla media), ecografia tiroidea annuale dall'infanzia o dall'adolescenza, controlli dermatologici per le lesioni cutanee caratteristiche e attenzione alla sorveglianza gastrointestinale e renale quando indicato.
La frequenza varia. Alcuni test sono annuali, altri sono raccomandati ogni sei mesi e alcuni, come la colonscopia, possono essere distanziati a intervalli più lunghi a seconda dei risultati precedenti. L'affermazione di Bella sugli esami ogni sei mesi illustra il livello massimo di intensità: revisioni cliniche e imaging due volte l'anno sono comuni quando un clinico ritiene che il controllo del rischio giustifichi tale cadenza. L'effetto pratico è un calendario a vita di appuntamenti, scansioni e, talvolta, biopsie — un ritmo medico che può sembrare incessante.
Tale programma risponde a una delle domande più comuni dei pazienti: con quale frequenza deve essere controllato chi ha un rischio ereditario di cancro? Non esiste una risposta univoca. I piani di screening sono guidati dall'evidenza, ove possibile, ma per le varianti rare o le presentazioni insolite i medici combinano linee guida pubblicate, competenze multidisciplinari e preferenze individuali per stabilire gli intervalli. Un team di genetica clinica raccomanderà spesso una sorveglianza più intensiva quando la storia familiare include molteplici tumori precoci, o quando l'effetto di una variante è scarsamente caratterizzato e i medici optano per la cautela.
Test genetici, opzioni e chi dovrebbe prenderli in considerazione
Test genetici oggi spaziano dai test a singolo gene (mirati quando si sospetta una sindrome specifica) ai pannelli multigenici che valutano contemporaneamente decine di geni associati al cancro. Il sequenziamento dell'intero esoma o dell'intero genoma viene talvolta utilizzato in contesti di ricerca o quando i test iniziali non sono rivelatori. Le persone che dovrebbero prendere in considerazione il test includono coloro che presentano molteplici tumori primari, una diagnosi insolitamente precoce, una forte storia familiare dello stesso tipo di tumore o di tumori correlati, o reperti benigni caratteristici — tutti segnali d'allarme della possibile presenza di una condizione ereditaria.
Una delle domande più comuni del pubblico è se lo stile di vita possa gestire un alto rischio di cancro. Comportamenti sani — smettere di fumare, moderare l'alcol, mantenere un peso salutare ed esercizio fisico regolare — riducono il rischio di cancro nella popolazione e possono influenzare modestamente gli esiti per alcuni individui, ma non annullano un rischio genetico ad alta penetranza. Per la sorveglianza guidata dai geni, il cambiamento dello stile di vita è complementare, non curativo.
Scelte di cura, costi e carico psicologico
Le decisioni sulla sorveglianza permanente sono mediche, finanziarie e profondamente personali. L'imaging regolare e le visite specialistiche aggiungono oneri in termini di costi, viaggi e tempo; in alcuni sistemi sanitari i pazienti devono affrontare spese vive che possono essere consistenti. Il reportage di 9News sulle persone che si recano all'estero per trattamenti sperimentali ha sottolineato un altro rischio: quando la medicina convenzionale offre opzioni limitate, i pazienti vulnerabili a volte perseguono terapie non provate con ingenti spese personali. I servizi nazionali di oncologia e genetica clinica consigliano cautela e incoraggiano il confronto con i medici locali prima di cercare cure sperimentali all'estero.
Il carico psicologico di test perpetui è reale. I pazienti descrivono l'ansia anticipatoria prima delle scansioni, il sollievo dei risultati negativi e la persistente consapevolezza di sottofondo che una diagnosi seria potrebbe comunque arrivare. Questa pesantezza condiziona la pianificazione familiare, la carriera e la vita quotidiana. La buona pratica clinica riconosce questo aspetto: i servizi di genetica includono tipicamente supporto psicosociale, reti di pari e invio a consulenza psicologica quando necessario.
Domande da porre al proprio medico sulla sorveglianza a vita
Quando le équipe di genetica o oncologia raccomandano una sorveglianza a lungo termine, i pazienti dovrebbero presentarsi preparati con alcune domande pratiche che definiscono il percorso di cura. Le domande chiave includono: Qual è il rischio stimato di cancro assoluto e relativo associato alla mia variante specifica? Quali esami raccomandate e con quale frequenza, e perché? Quali sono i benefici, i danni e i probabili esiti di uno screening intensificato? Esistono opzioni chirurgiche o mediche di riduzione del rischio che dovrei considerare? Come verranno comunicati i risultati e quale supporto è disponibile in caso di una nuova diagnosi?
Chiedete anche le implicazioni per la famiglia: a chi nella mia famiglia dovrebbe essere offerto il test, e quali sono le implicazioni per l'assicurazione e l'occupazione, ove pertinente? Infine, informatevi su sperimentazioni cliniche e registri — la partecipazione può fornire l'accesso a nuove opzioni e aiutare a costruire la base di evidenze per le varianti rare, il che è fondamentale quando una particolare alterazione genetica è poco comune.
La storia di Bella Grambau è un vivido promemoria del fatto che, per alcune persone, la genetica trasforma l'incertezza del futuro in una vita di vigilanza. Tale vigilanza — imaging frequente, revisioni specialistiche e consulenza genetica — può individuare i tumori precocemente quando sono più trattabili, ma richiede anche un sistema sanitario pronto a sostenere i costi medici, finanziari ed emotivi. Man mano che i test genetici diventano più comuni e i pannelli rilevano varianti sempre più rare, clinici, pazienti e servizi sanitari devono collaborare per trasformare la conoscenza in piani di cura sensati e sostenibili.
Fonti
- Gold Coast University Hospital (servizi di genetica clinica e oncologia)
- Cancer Council Australia (guida nazionale e informazioni per i pazienti)

Comments
No comments yet. Be the first!